- 欢迎来到细胞产业关键共性技术国家工程研究中心!
MSC大规模生产工艺的对比与选择:细胞工厂贴壁与微载体贴壁

来源:先进细胞智造系统研发平台
建设单位:深圳赛动智造科技有限公司
时间:2024-12-30
间充质干细胞(MSC)在临床上应用范围较广[1],其临床价值很大一部分来源于它的抗炎与抗纤维化特性。MSC可以分泌各类细胞因子和可溶性物质来调节免疫细胞活性和促进组织再生,近年来MSC来源的外泌体也展示出应用于组织修复再生的潜力[2-5]。随着越来越多同种异体MSC相关的临床试验进入三期临床,如何选择和设计符合GMP标准的规模化生产方案以满足十亿百亿以上细胞量的生产、发放和质量控制,是MSC细胞治疗行业迫切需要解决的问题之一[6]。
目前对MSC规模化生产方式的选择,主要集中在以细胞工厂贴壁培养与普通二氧化碳培养箱结合的传统培养工艺、以微载体贴壁培养与生物反应器结合、以及不需要微载体的悬浮培养的新工艺对比上。贴壁培养(细胞工厂)的优势主要体现在其成熟的培养工艺和已知的成本,以及大量企业对培养设备的优化和自动化工艺设计(如深圳赛动智造的全密闭矩阵式培养单元和基于细胞工厂的MSC自动化产线)和临床试验案例[6],但其难点在于如何控制大规模培养的成本;而微载体贴壁培养的优势目前在于其较高的面积体积比和大规模培养的潜在优势,但其难点在于其并不成熟的培养工艺、难以界定的关键质量属性(CQA)以及如何满足先进治疗药品的GMP生产要求等[7]。
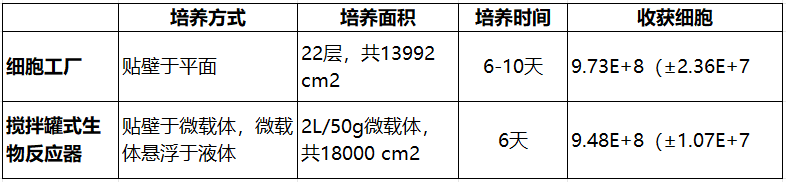
在实际应用中,多层多平面的细胞工厂培养方式如某公司的CellSTACK目前可达40层共25,440cm²,但是同时使用大量细胞工厂不便于操作且难以有效观察不同平面的细胞生长状态。微载体贴壁则具有高效利用有限体积大量扩增MSC的可能性,但其技术上仍需充分的培养参数验证以保证其工艺的重复性和获得细胞的性状一致性[7]。López-Fernández, A.等人[8]对MSC的细胞工厂培养和微载体/搅拌罐式生物反应器进行了对比。结果显示,CellSTACK细胞工厂的22层细胞量略高于2L/50g微载体反应器的细胞量(表1)。Kurogi, H.等人[9]在培养对比中也发现传统贴壁培养与微载体贴壁培养的细胞倍增水平相当。上述结果提示,同等培养面积下细胞工厂培养与微载体培养的细胞扩增效率和收获细胞量并无明显差异。此外,据Kusuma, G.D.等人报道[10],无载体悬浮培养方式培养的MSC分泌的外泌体(3D MSC-EVs)相较于平面培养的而言,其吲哚胺2,3双加氧酶(免疫抑制作用)的分泌量显著性下降,同时3D MSC-EVs也显著性降低了巨噬细胞的吞噬能力(抗炎能力)。在该报道的动物肺纤维化模型中,3D MSC-EVs增加了肺部的胶原蛋白沉积、肌纤维母细胞分化和淋巴细胞浸润,且3D MSC-EVs增加了呼吸系统阻力,反而不利于肺纤维化的治疗。考虑到回输体内的MSC细胞在自身发挥效果的同时也分泌外泌体和细胞因子等发挥作用,在细胞工厂与微载体的选择上需要慎重考虑不同培养方式对MSC细胞及其分泌物的生物学功能的影响。因此,基于细胞性状与生物学功能、技术成熟度和生产成本等考量因素,如果微载体培养方式的有效细胞收获量不能远高于细胞工厂培养的收获量,企业在III期临床试验阶段需充分考量更换培养方式的必要性、可行性以及更换的显性成本与隐性成本。
表1细胞工厂与搅拌罐式生物反应器细胞培养对比[8]
目前已上市MSC治疗产品的企业[11],其生产模式以细胞工厂培养方式为主,同步进行生物反应器的生产工艺开发。如近期在美国上市的Ryoncil(remestemcel-L-rknd),为同种异体BM-MSC疗法,用以治疗用于治疗2个月及以上儿童患者的类固醇难治性急性移植物抗宿主病(SR-aGVHD),其公司Mesoblast就是使用细胞工厂进行Ryoncil的生产(图1),同时并行开发大规模的生物反应器培养工艺[12]。值得注意的是,Ryoncil的生产是委托Lonza进行的[13, 14],而Lonza的GMP生产基地具有一套完成的基于细胞工厂的生产厂房。此外,2015年在日本上市的TEMCELL® HS(用于治疗成人与儿童的aGVHD),也是Mesoblast公司授权JCR Pharmaceuticals的一款BM-MSC[15]。在全球已上市的12款MSC产品中[11],除了Mesoblast和JCR Pharmaceuticals公司使用细胞工厂的方式生产MSC以外,Stempeutics Research公司的Stempeucel明确使用10层CellStack(CN201080053627)进行生产,Medipost公司的Cartistem[16]和Takeda公司的Alofisel[17]使用细胞工厂培养的方式进行生产。由于Anterogen公司的Queencell和Cupistem[18]、Chiesi Farmaceutici公司的Holoclar、Cell Tech Pharmed公司的MesestroCell、Nipro Corp公司的Stemirac、Corestem公司的NeuroNataR以及Pharmicell公司的Cellgram AMI均为自体组织来源的MSC,所以无需大规模生产,仅小规模贴壁培养即可。
综上所述,如何利用已有的稳定培养方案(细胞工厂)高效生产步入III期临床的MSC产品,对新的产品管线同步开发新的基于微载体的贴壁工艺或无载体的悬浮培养工艺以适应未来的市场需求,可能是一种合适的选择。

图1 Ryoncil在Lonza新加坡GMP厂房中生产
[1] Levy, O., et al., Shattering barriers toward clinically meaningful MSC therapies. Sci Adv, 2020. 6(30): p. eaba6884.
[2] Baglio, S.R., D.M. Pegtel, and N. Baldini, Mesenchymal stem cell secreted vesicles provide novel opportunities in (stem) cell-free therapy. Front Physiol, 2012. 3: p. 359.
[3] Chen, B., et al., Stem Cell-Derived Extracellular Vesicles as a Novel Potential Therapeutic Tool for Tissue Repair. Stem Cells Transl Med, 2017. 6(9): p. 1753-1758.
[4] Claridge, B., et al., Development of Extracellular Vesicle Therapeutics: Challenges, Considerations, and Opportunities. Front Cell Dev Biol, 2021. 9: p. 734720.
[5] György, B., et al., Therapeutic applications of extracellular vesicles: clinical promise and open questions. Annu Rev Pharmacol Toxicol, 2015. 55: p. 439-464.
[6] Lechanteur, C., et al., MSC Manufacturing for Academic Clinical Trials: From a Clinical-Grade to a Full GMP-Compliant Process. Cells, 2021. 10(6).
[7] Tsai, A.C. and C.A. Pacak, Bioprocessing of Human Mesenchymal Stem Cells: From Planar Culture to Microcarrier-Based Bioreactors. Bioengineering (Basel), 2021. 8(7).
[8] López-Fernández, A., et al., Comparability exercise of critical quality attributes of clinical-grade human mesenchymal stromal cells from the Wharton's jelly: single-use stirred tank bioreactors versus planar culture systems. Cytotherapy, 2024. 26(5): p. 418-426.
[9] Kurogi, H., et al., Umbilical cord derived mesenchymal stromal cells in microcarrier based industrial scale culture sustain the immune regulatory functions. Biotechnol J, 2021. 16(6): p. e2000558.
[10] Kusuma, G.D., et al., Effect of 2D and 3D Culture Microenvironments on Mesenchymal Stem Cell-Derived Extracellular Vesicles Potencies. Front Cell Dev Biol, 2022. 10: p. 819726.
[11] Fernández-Garza, L.E., S.A. Barrera-Barrera, and H.A. Barrera-Saldaña, Mesenchymal Stem Cell Therapies Approved by Regulatory Agencies around the World. Pharmaceuticals (Basel), 2023. 16(9).
[12] Manufacturing – Mesoblast Ltd. Available from:
https://mesoblast.com/science/manufacturing.
[13] CellBio Services | Lonza. Available from:
https://bioscience.lonza.com/lonza_bs/CN/en/cellbio-services-custom-research.
[14]Mesoblast_Corporate_Overview_June_2020.Available from:
https://mesoblast.com/images/Mesoblast_Corporate_Overview_June_2020.pdf.
[15] JCR Pharma launch TEMCELL® HS in Japan • Biopharma Asia. Available from:
https://biopharma-asia.com/sections/jcr-pharma-launch-temcell-hs-in-japan/.
[16] GMP Center – MEDIPOST. Available from:
https://en.medi-post.co.kr/gmp/.
[17] de la Portilla, F., et al., Expanded allogeneic adipose-derived stem cells (eASCs) for the treatment of complex perianal fistula in Crohn's disease: results from a multicenter phase I/IIa clinical trial. Int J Colorectal Dis, 2013. 28(3): p. 313-23.
[18] (Cell therapy products) ANTEROGEN. Available from:
https://www.mfds.go.kr/eng/brd/m_30/view.do?seq=71337.
