- 欢迎来到细胞产业关键共性技术国家工程研究中心!
研究发现Car-T有时候会没有效果,生产是一个原因

来源:先进细胞智造系统研发平台
承载单位:深圳赛动智造科技有限公司
时间:2022-10-25

刘沐芸
细胞产业关键共性技术国家工程研究中心 主任
中国(深圳)综合开发研究院 特约研究员
《中华细胞与干细胞杂志》 副总编辑
虽然Car-T治疗血液肿瘤非常有效,但临床中,有些患者不久就会复发。因此,科学家对淋巴瘤治疗后复发的患者展开了研究,发现超过一半的淋巴瘤患者治疗后会复发的原因,与Car-T产品的生产有关。斯坦福和哈佛大学2个团队分别开展了独立研究,从生产过程入手,找到了共同的原因,文章发表在今年9月的《Cell》杂志上。
细胞公司从患者外周血中提取T细胞,在生产车间为其装配嵌合抗原受体(CAR),从而高度激活T细胞,使其能够识别并摧毁癌细胞。生产过程中,不同类型的T细胞都能装上并携带上CAR,比如T细胞不同的亚型,辅助T细胞和杀伤T细胞等都能被装上CAR。2个团队研究的目标都是想了解,为什么回输Car-T后,有的患者疗效非常稳定,而有的患者会很快复发?这两类患者回输的Car-T有什么不同吗?
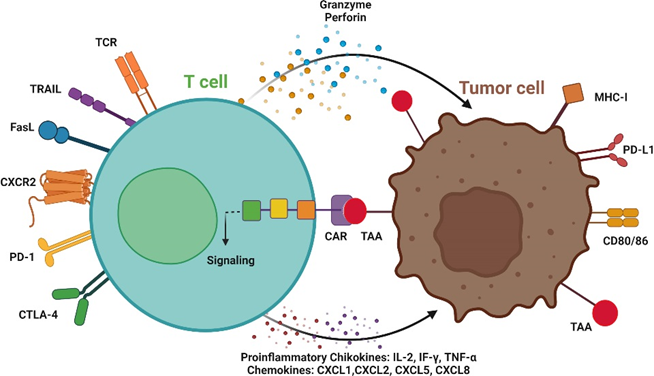
CAR-T细胞疗法作用机制
这时,计算生物学就发挥了作用。哈佛大学团队分别对回输前的Car-T细胞进行了研究,然后回输到患者体内,再从同一个患者身上取得血样以观察输入后的Car-T细胞,通过对单个Car-T细胞中的所有RNA进行测序,以了解Car-T细胞的外观形态和行为。斯坦福团队同样也对回输前和输入患者体内后的Car-T进行了观察分析,通过研究单个细胞中的蛋白质的组合来分析这些细胞。结果2个团队都发现了意想不到的事情。
哈佛大学团队发现,接受Car-T治疗的患者中输入的Car-T产品,有一部分是调节性T细胞(Treg细胞),这一发现引起了研究团队的兴趣。通常,在正常的血液中,Tregs就如同是一个T细胞的安全开关,在人体内四处游走,发现并破坏其他感染或疾病细胞。
Tregs细胞是T细胞含量很小但很活跃的亚型类别,通常,Tregs会聚集在杀伤性T细胞的周围,以预防杀伤性T细胞过度活跃引发自身免疫性反应。其主要工作就是预防人体免疫系统攻击人体自身,具有很强的抑制性,以抑制正常免疫反应中的效应T细胞。
因此,2个团队不约而同地假设,是否Car-Treg细胞抑制了Car-T细胞,导致Car-T无法杀灭癌细胞,患者复发。研究发现,相较于治疗效果一般的患者,Car-T治疗效果好的患者血液中的Car-Treg细胞非常地少——不到2%,而没有反应的患者中的Car-Treg细胞则到了5-6%。同时也发现,Car-Tregs含量高的患者,其发生的副反应也轻,但同时治疗效果也一般,这就是一个悖论。研究发现也证明了假设的正确性。

CAR-TReg与淋巴瘤患者抗CD19 CAR-T细胞治疗效果相关
通过对给患者回输之前的Car- T产品进行测序分析,也发现同样的现象。分装在输液袋内的Car-T产品中,Car-Treg细胞含量越低,患者的治疗效果越好;Car-T产品中的Car-Treg细胞含量越高,患者的治疗效果越差。
为了进一步证明,Car- Treg细胞是否就是直接影响患者治疗效果的“罪魁祸首”,研究团队在动物模型上进行验证。一袋产品中混了95%的传统的T细胞+5%的Car-Tregs,对照组则是,95%的传统Car-T与正常T细胞相混合。结果证明,终产品中只要有5%的Car-Treg就足够引发患者治疗无效,肿瘤复发。
导致Car-T产品中出现Car-Treg细胞的可能是导致Car-T治疗失败的原因,可能有如下几种:一是患者的个体微环境生理差异,一个是肿瘤微环境的生理差异,再一个就是Car-T生产的原因。
两个独立团队研究揭示其主要原因,还是存在于生产中的过程控制,分选T细胞时的纯度不够,混入了正常的Treg细胞,并且与T细胞一样都被装上了Car。主要是一个分选后的过程控制,无法有效地将Treg细胞组分从T细胞中分离出来;然后,在终产品放行检测时,缺乏有效区分“装配好Car的细胞是Car-T细胞,还是Car-Treg细胞”的方法和工具。
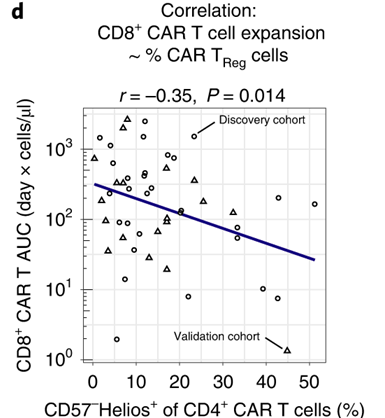
CAR-TReg细胞和CD8 CAR-T细胞扩增呈负相关
虽然研究发现了生产与过程控制会导致Car-T产品中会混有Car-Treg细胞,并对临床治疗效果产生影响,导致患者复发。但估计这个研究发现不会对现有已经上市的Car-T产品的临床现状有所改变,因为已经获批上市的产品要做工艺修改,或增加过程控制检测,就需要开展新的临床研究项目,而这是一个漫长而昂贵的过程。
但对于新的Car-T产品研发公司,这是一个必须要克服的生产工艺和质量控制障碍,在分选的过程需要增加质控点和检测以有效分选出去除了Treg细胞的T细胞,而不是含有5%或以上的Treg细胞的T细胞;终产品放行检测时,则需要重新调整放行的检测方法和放行标准,以表明其是Car-T细胞,而不是含有Car-Tregs的Car-T产品。
Car-T产品自2017年在美国获批上市以来,目前已经是全球研究最多、注册申报公司最多的一种畅销的个体化细胞治疗产品。但对于Car-T产品临床副反应、或临床治疗效果不佳的研究比较少。至今印象较深的关于Car-T副反应研究的文章,是2018年,Carl June在“自然医学”杂志发表的一篇“Car-T耐药导致一名白血病复发并死亡”的个案报导,揭示了生产过程中,也是分选过程中残留了B细胞,以至于Car-T的终产品中混了一些Car-B细胞,因此导致治疗无效并出现耐药。然后就是这次同时发表的2个团队独立开展的回答“为什么Car-T会无效”的研究。
今天,我们有如此之多的研究经费,社会资本和基金都用于Car-T的开发,使得Car-T在获批上市短短的5年之间,就从创新药变成了普药,如同曾经的PD1和PDL1一样,但这个领域中,有挑战的地方还是有挑战。比如,虽然Car-T的疗效如此好,但并不是人人用得上——大规模批量生产的问题几乎无人关注,以至于美国出现了需要“患者抓阄”的方式决定“谁先谁后”的生产排期;也并不是人人用得起——单人单批次的手工生产方式不仅生产繁琐,成本必然高居不下,也必然导致产品质量的不均一,也就是本文所说的有的患者有效,有的患者不仅没效还很快复发等等,这些问题的研究探索与创新创业等都鲜能引起行业的重视和资本的青睐。
虽然目前,已有多个Car-T产品获批上市,并且现有的管线不断重复,但Car-T需要回答的问题以及需要得到重视和投入的地方,远不止管线研发。例如,如何突破当前“一个批次只为一个患者治疗”的生产瓶颈,实现个体化药物的“连续性、封闭式、大规模”的生产制造?如何通过临床治疗效果的反馈高效地优化工艺以提升已上市Car-T产品的临床疗效、过程控制的问题等等,比如本文提到的“安全性好,但疗效就差”的悖论问题,比如2018年Carl June发现的耐药性问题等等,这些都值得我们关注。从今年的诺贝尔生理学/医学奖以及化学奖的选择来看,成功的路上并不是“挤在一个众所周知”的领域和赛道,另辟蹊径但对行业具有奠基性作用的“冷门”也值得关注,不仅能出成果而且可能更容易问鼎诺奖。还有一个好处就是,冷门通往成功的路上也不拥挤,但需要耐心和眼光。
